Содержание
Эпидемии гриппа охватывают нас ежегодными волнами. Мы уже воспринимаем их как обычные и забываем о таящейся опасности. В этой статье спецпроекта «Вакцинация» мы подробно расскажем вам о вирусе гриппа; что будет, если они заразятся; и почему не стоит пренебрегать следующей прививкой.

Вакцинация

Генеральный партнер спецпроекта — Фонд Зимина.

Издательский партнер данной статьи – фармацевтический холдинг «Национальная иммунобиологическая компания», созданный Госкорпорацией Ростех в 2013 году с целью развития производства иммунобиологических препаратов, важных для национальной безопасности.
Изобретение вакцин коренным образом изменило жизнь человечества. Многие заболевания, которые ежегодно уносили тысячи, если не миллионы жизней, в настоящее время практически не существуют. В данном конкретном проекте мы не только рассказываем об истории вакцин, общих принципах их разработки и роли вакцинопрофилактики в современном здравоохранении (этому посвящены первые три статьи), но и подробно рассказываем о каждой вакцине включенных в Национальный календарь прививок, а также вакцин против гриппа и вируса папилломы человека. Вы узнаете о том, что собой представляет каждый из возбудителей, какие варианты вакцин существуют и чем они отличаются друг от друга, затронем тему поствакцинальных осложнений и эффективности вакцин.
Для сохранения объективности кураторами спецпроекта мы пригласили Александра Соломоновича Апта, доктора биологических наук, профессора МГУ, заведующего лабораторией иммуногенетики НИИ туберкулеза (Москва); , — а также Сергей Александрович Бутрия — педиатр, автор блога «Записки педиатра».
Современное медицинское и научное сообщество уже много знает о гриппе, но с трудом с ним справляется. По оценкам Всемирной организации здравоохранения (ВОЗ), от 3 до 5 миллионов человек ежегодно серьезно заболевают во время эпидемий гриппа и от 290 000 до 650 000 умирают. Только в США в прошлом сезоне (2019 г.) было зарегистрировано до 740 000 госпитализаций и до 62 000 смертей от гриппа. В то же время вирус мутирует настолько быстро, что мы едва успеваем за ним в разработке новых лекарств и вакцин. Хотя здоровый взрослый часто не боится гриппа — неделя в постели и ты здоров — мы все причастны к его распространению и несем ответственность за последствия. И правда в том, что у нас нет ничего более эффективного для предотвращения эпидемий, чем вакцина против гриппа.
Существуют различные гипотезы о происхождении названия «грипп». По одной из них, оно заимствовано из французского языка (grippe) и трактуется как производное от глагола gripper — «хватать». По другой версии, первоисточником названия является слово «гес» («хрипеть») 1. Столь же сложно проследить историю эпидемий и пандемий, вызванных вирусом гриппа. В эпоху до развития вирусологии это было практически невозможно, так как симптомы гриппа очень схожи с симптомами многих других заболеваний, не говоря уже о том, что до конца 18 века никто не проводил систематических наблюдений и записи пациентов [2].
Вероятно, мы можем говорить только о двенадцати пандемиях, произошедших с 1510 года. Их можно идентифицировать по задокументированным случаям лихорадки и простудных симптомов, быстрому и взрывному распространению в нескольких географических регионах, заболеваемости в широком возрастном диапазоне и повышенной смертности среди пожилых людей, детей, беременных женщин и людей со слабым здоровьем [2].
Самая страшная из пандемий («испанка», или «испанка») охватила мир в 1918-1920 гг. (рис. 1). По разным оценкам, от него умерло от 50 до 100 млн человек (3–6% населения мира) [3]. В попытке изучить смертоносную природу «испанки» в 1997 г группе исследователей удалось восстановить нуклеотидные последовательности небольших фрагментов вирусного генома, выделенных из образцов тканей жертв пандемии [4]. Эти и другие результаты показали, что люди ранее не сталкивались с этим штаммом вируса гриппа, который, вероятно, произошел от одного из вирусов птичьего гриппа. Впоследствии вирус, вызвавший испанский грипп, стал «матерью всех пандемий гриппа» в 20-м и 21-м веках.
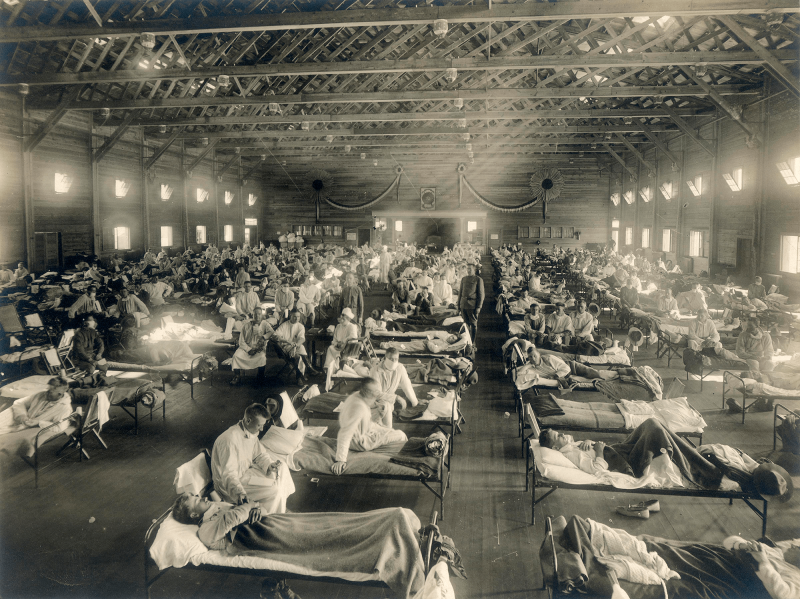
Рисунок 1а. Испанский грипп, 1918–1920 гг. Солдаты с испанкой из Форт-Райли (Канзас, США) в больничной палате лагеря Фанстон.
Википедия

Рисунок 1б. Испанский грипп, 1918–1920 гг. Полиция Сиэтла, штат Вашингтон, США, носила маски, чтобы защитить себя во время пандемии гриппа 1918 г.
[66]
В 20 веке врачи испробовали множество методов лечения гриппа, от переливания крови до оксигенотерапии и разработки вакцин и сывороток против бактерии Haemophilus influenzae, которая до 1933 года ошибочно считалась причиной гриппа. Все это, как и народные средства, не давало результатов, и лишь переливание крови от здоровых больных имело хоть какой-то успех [5]. Вскоре после того, как Уилсон Смит и его коллеги однозначно продемонстрировали вирусную природу заболевания и выделили возбудитель, начались усилия по созданию вакцины против гриппа (рис. 2).

Рисунок 2. История исследований вируса гриппа и разработки вакцины. 1933 г. Уилсон Смит, Кристофер Эндрюс и Патрик Лейдлоу выделили вирус гриппа А. 1936 г. Советский ученый Анатолий Смородинцев создал первую аттенуированную вакцину против гриппа. 1937 Вирус гриппа научился расти в куриных эмбрионах. В 1940 г был открыт вирус гриппа В, который репродуцировался в куриных эмбрионах так же, как и вирус гриппа А, но обладал другими антигенными свойствами. 1942 г. Разработка и испытание двухвалентной инактивированной вакцины против гриппа, содержащей вирусы гриппа А и В. 1945 г. Одобрена первая инактивированная вакцина против гриппа для гражданского использования в США. 1947 г. Обнаружена способность вируса изменять антигенные свойства (антигенный дрейф), снижающая эффективность вакцины. 1973 г. ВОЗ начинает делать прогнозы и давать рекомендации по составу противогриппозных вакцин на основе данных эпидемиологических лабораторий мира. 1978 Производство трехвалентной вакцины (одновременно циркулируют два штамма вируса гриппа А и один штамм вируса гриппа В). В 2013 г. ВОЗ начала давать рекомендации по составу четырехвалентной вакцины, включающей второй штамм вируса гриппа В [6].
иллюстрация Ирины Ефремовой

Рисунок 3. Советский агитационный плакат. Художник Н.А. Игнатьев, 1959 год.
«Как российский вирусолог Анатолий Смородинцев разработал первую в мире живую вакцину против гриппа»
Первая аттенуированная (ослабленная) вакцина была разработана нашим соотечественником Анатолием Александровичем Смородинцевым в 1936 г. Более 50 лет она широко применялась на территории СССР (рис. 3) [6]. В то же время другие группы исследователей работали над созданием инактивированных вакцин. В 1937 г австралийский ученый Фрэнк Бернет предложил относительно простой метод выращивания вируса в куриных эмбрионах, позволивший получить достаточное количество вирионов для изготовления убитой вакцины [6]. Затем, в 1940 г., был выделен еще один вирус гриппа, также широко распространенный в человеческой популяции, но существенно отличающийся по антигенным свойствам от ранее изученных вариантов. Новый вирус был назван вирусом гриппа В, а ранее обнаруженный вирус был назван «вирусом гриппа А». Второй вариант практически сразу дополнил состав инактивированной вакцины, имевшей эффективность около 69% и начавшей широко применяться в армии США в 1944 г., а затем и среди городского населения [6].
Чтобы ослабить вирус, его выращивают в других культурах клеток или живых организмах. После того, как вирус адаптируется к новым условиям, он намного хуже размножается в организме человека и не вызывает серьезного заболевания, но все же активирует иммунную систему — на этом основано действие живых аттенуированных вакцин. Подробнее о видах вакцин читайте в статье «Разработка вакцин: как и как имитировать заболевание?» [7]. — Эд.
Что мы знаем о вирусе гриппа
В природе циркулируют четыре типа вируса гриппа из семейства ортомиксовирусов (Orthomyxoviridae). Мы расскажем только о двух из них – А и Б – так как они представляют для нас наибольшую опасность. Вирус гриппа С также поражает людей, но не вызывает серьезных заболеваний [8]. Доказательств того, что недавно открытый вирус гриппа D заражает не только свиней и крупный рогатый скот, пока не найдено [9].
Строение и жизненный цикл
Под электронным микроскопом частицы вирусов гриппа А и В практически неразличимы: те и другие имеют сферическую или нитевидную форму диаметром 100 нм и длиной (в случае нитевидной формы) примерно 300 нм [10]. Их структура также практически идентична. Условно ее можно разделить на три части: наружную мембрану, белковую оболочку (или матрикс) и генетический материал (рис. 4).
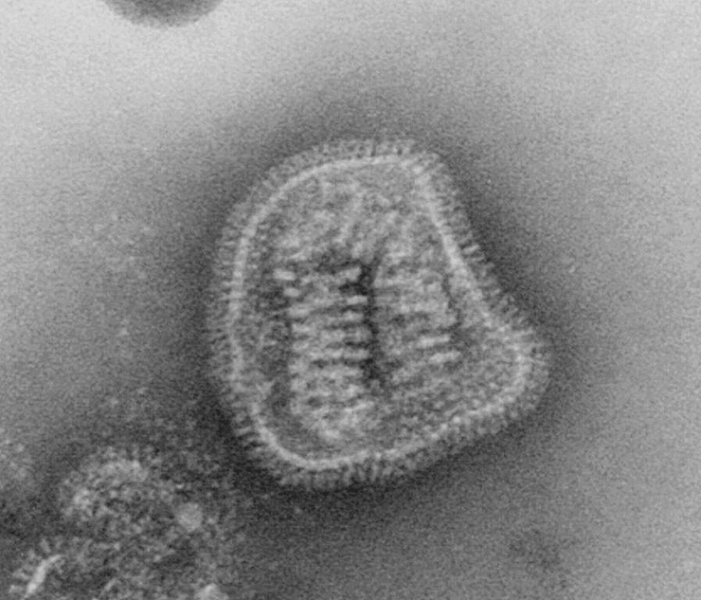
Рисунок 4а. Электронно-микроскопическое изображение частиц вируса гриппа (негативное окрашивание)
Википедия
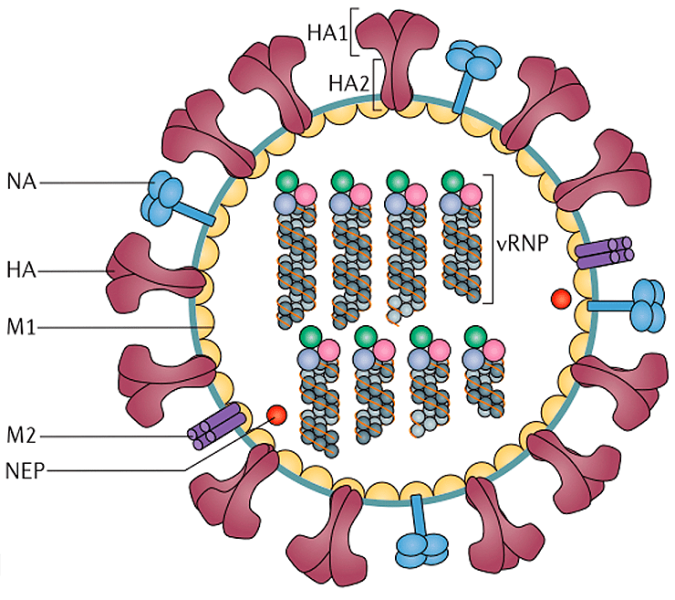
Рисунок 4б. Строение вирусной частицы (вириона) вируса гриппа. Схема строения вируса гриппа А Обозначения: НА — гемагглютинин; НА1 и НА2 — субъединицы гемагглютинина; NA, нейраминидаза; M1, белок матрикса; M2, белки ионных каналов; NEP, белок ядерного экспорта; вРНП — сегменты вирусного генома в виде комплекса РНК и белков.
[восемь]

Рисунок 4с. Строение вирусной частицы (вириона) вируса гриппа. Самая надежная модель вируса гриппа A H1N1 в атомарном разрешении.
[17]
На поверхности вирусной частицы находятся основные мишени иммунной системы и компоненты многих противогриппозных вакцин — белки гемагглютинин (НА) и нейраминидаза (НА). Первый необходим для проникновения в клетку-хозяин, а второй – для успешного высвобождения вирусной частицы. Также считается, что нейраминидаза облегчает прохождение вируса через слизистую дыхательных путей [8], [10]. Наряду с этими белками во внешнюю липидную оболочку встроен ионный канал, состоящий из белков М2 (или NB и ВМ2 в случае вируса гриппа В). Изнутри вирион выстлан матриксным белком М1, который, помимо механической защиты, необходим для успешной распаковки вирусной частицы и сборки новых потомков. В самом центре частицы хранится вирусный геном в виде восьми молекул (сегментов) РНК, покрытых нуклеопротеином (НП) и связанных с вирусной полимеразой.
Чтобы вирус проник в клетку, гемагглютинин связывается с остатками сиаловой кислоты на поверхности наших клеток по принципу «ключ к замку». Клетка захватывает связанный вирус, окружая его внешней мембраной, точно так же, как она «съедает» многие питательные вещества, которые затем «переваривает» на кусочки. Но вирусу гриппа удается перехитрить систему и вырваться из этой цепочки. Для пищеварения клетка подкисляет среду внутри мембранного пузырька вирусом, что вызывает структурные изменения гемагглютинина и последующее слияние мембран вируса и клеточного пузырька. Кроме того, в вирион по ионному каналу закачиваются протоны (Н+), что приводит к изменению структуры матриксного белка М1 и выходу комплекса из РНК и белков во внутриклеточную среду (рис. 5, видео 1).)) [8], [10].
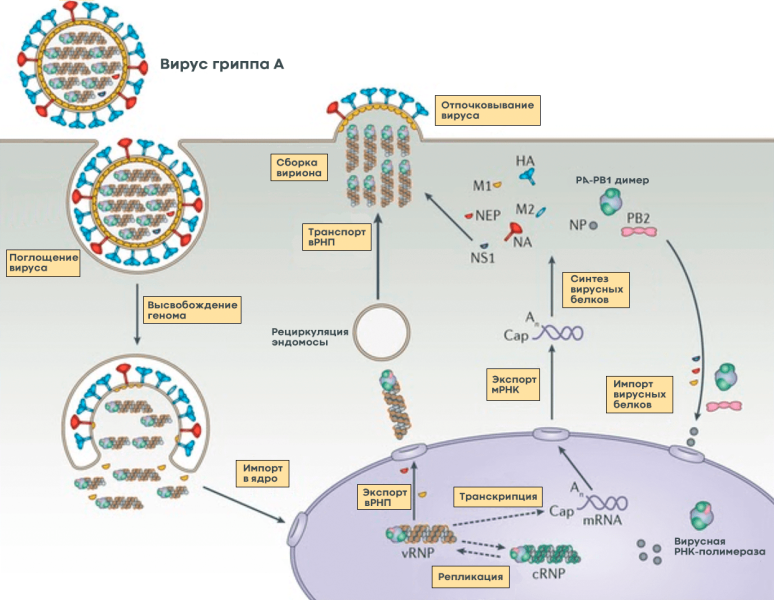
Рис. 5. Жизненный цикл вируса гриппа А. После «поглощения» клеткой вируса гриппа мембрана вируса сливается с мембраной клеточного пузырька, в результате чего происходит высвобождение вирусного генома в виде комплекса РНК и белков (vRNP), который транспортируется к ядру. В ядре клетки вирусная РНК-полимераза синтезирует копии генома с помощью промежуточного комплекса комплементарных РНК и белков (кРНП) — процесс, называемый репликацией. Вирусная РНК-полимераза также осуществляет транскрипцию – она синтезирует вирусную информационную РНК (мРНК), которая затем транспортируется в цитоплазму клетки и используется для синтеза вирусных белков. Часть белков возвращается в ядро для запуска новых циклов репликации (образования новых геномных вРНП), а другая часть участвует в сборке вириона в цитоплазме. Новые вРНП также транспортируются к месту сборки. Вирусные белки, которые должны быть включены в мембрану, транспортируются к месту сборки за счет рециркуляции клеточных везикул. После сборки вирион отделяется от клетки путем почкования. Обозначения: НА — гемагглютинин; NA, нейраминидаза; M1 и M2 представляют собой матриксные белки 1 и 2 соответственно; NP, нуклеопротеин; PA, PB1 и PB2 — субъединицы РНК-полимеразы; NEP и NS1 являются неструктурными белками; вРНП, вРНП; кРНП, кРНП; мРНК — мРНК.
[67]
Видео 1. Взаимодействие вируса гриппа с клетками
Вирусная РНК проникает в ядро клетки, где начинается синтез РНК с образованием новых вирусных белков (информационной РНК или мРНК) и новой геномной РНК. Новые копии вирусного генома сразу же «облачаются» в нуклеопротеин, связываются с полимеразой и покидают ядро (для чего нужен белок NEP). Сборка новых вирусных частиц происходит на внутренней стороне клеточной мембраны, в которую к этому времени уже встроены вирусные мембранные белки. Готовый вирус отделяется (отпочковывается) от клетки, но полностью не освобождается, так как гемагглютинин сразу связывается с остатками сиаловой кислоты на поверхности той же клетки. На этом этапе ключевую роль играет нейраминидаза, удаляющая с поверхности клетки остатки сиаловой кислоты и гемагглютинин, после чего вирус отправляется в свободное плавание для заражения новых клеток. В конце всего этого цикла из каждой клетки выходит до 15 тысяч новых вирусных частиц [11].
Гриппозная тирания
Чтобы клетка могла синтезировать белки на основе вирусной мРНК, а также на основе клеточной, матричная РНК должна содержать кэп и поли(А)хвост, специальные структуры на концах мРНК, выполняющие сигнальные функции. Поли(А)-хвост вируса гриппа может быть легко изготовлен сам по себе, но для получения кэпа вирусная полимераза отрезает его вместе с 5′-фрагментом мРНК от клетки-хозяина и использует полученный фрагмент в качестве «затравки». », из которого он начинает синтезировать собственную мРНК (рис. 6). Это явление получило название cap-snatching (от англ snatch — «хватать», «украсть») или «молекулярный каннибализм». При этом вирусная полимераза ингибирует синтез клеточной мРНК и способствует деградации клеточной РНК-полимеразы, что приводит к подавлению экспрессии (функционального проявления) генов клетки-хозяина. Этот процесс высокоэффективен — уже через шесть часов после заражения примерно 50% всей мРНК в клетке является вирусной [12]!
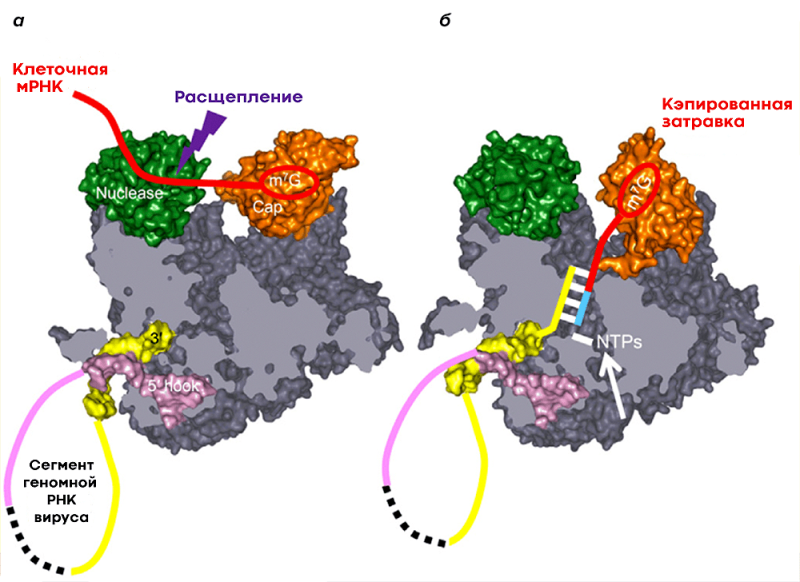
Рисунок 6. Кэп-зависимый синтез мРНК вируса. (а) Часть заблокированного фрагмента клеточной мРНК (красный). Концы генома вирусной РНК (один из сегментов) отмечены желтым и фиолетовым цветом б — Связывание разрезанного фрагмента с геномной РНК и инициация синтеза вирусной мРНК (синий).
[12]
Почему погоня за гриппом никогда не закончится
Вирус гриппа характеризуется чрезвычайной изменчивостью своего генома. Каждый сезон появляются новые генетические варианты (штаммы) вируса, отличающиеся по своим антигенным свойствам от своих предшественников, и сформировавшаяся у нас ранее иммунологическая память вновь и вновь оказывается бесполезной против них. Для выделения отдельных штаммов была создана специальная номенклатура, включающая, помимо видовых и антигенных свойств вируса, информацию о месте и времени выделения данного образца (рис. 7а). А на портале Nextstrain можно отследить интенсивность, с которой происходит образование новых штаммов, их расположение на ветвях эволюционного дерева (принадлежность к генетическим линиям) и распространение по миру (рис. 7б).
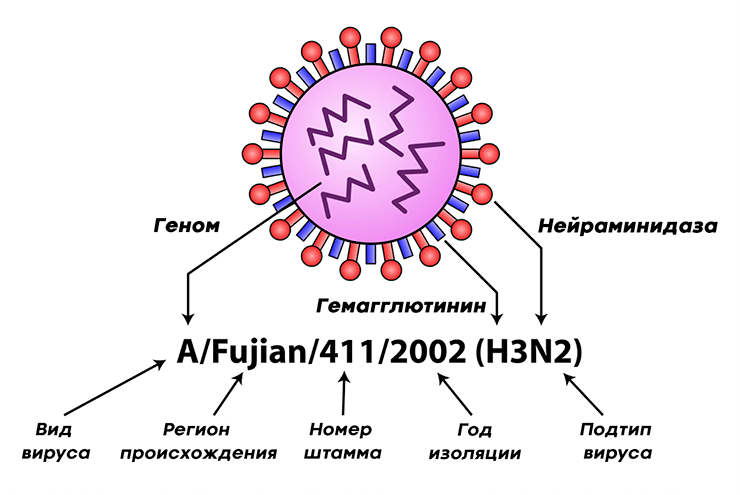
Рисунок 7а. Классификация вируса гриппа на примере вируса гриппа А Название образца (штамма) состоит из названия типа (типа) вируса, региона, в котором он был обнаружен, порядкового номера образца, год его получения и подтип вируса. Подтип вируса существует только для вируса гриппа А и формируется из порядковых номеров вариантов гемагглютинина и нейраминидазы на поверхности этого штамма.
Википедия
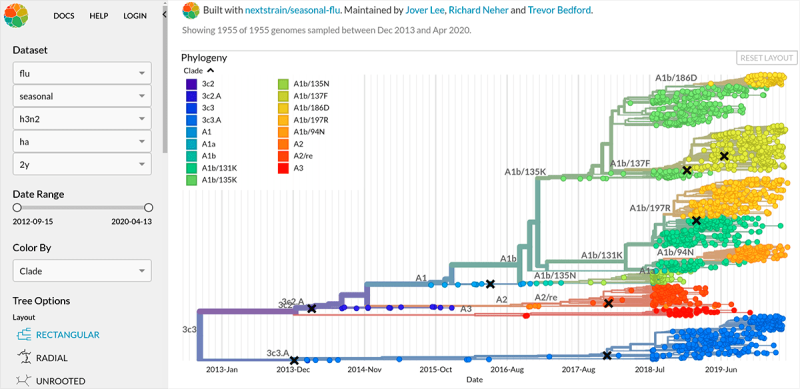
Рисунок 7б. Фрагмент меню и филогенетическое дерево с портала Nextstrain. Изменяя параметры на левой панели, вы можете просматривать данные образцов различных штаммов вирусов гриппа А и В, собранных по всему миру. На схеме филогенетического дерева видно, что только в одном белке (гемагглютинине) вируса гриппа А H3N2 всего за год появляется большое количество мутаций, и еще больше их накапливается по всему вирусу. Также на сайте можно проследить распространение штаммов в разных регионах планеты, накопление мутаций в разных положениях гемагглютинина или нейраминидазы и другие характеристики.
Следующая загрузка
Механизмы, которые вирус гриппа использует для достижения такого разнообразия, представляют собой дрейф антигена и сдвиг антигена.
Антигенный дрейф — это постепенное накопление мутаций из-за ошибок, допущенных вирусной полимеразой при копировании генома. В то же время полимеразы, синтезирующие РНК, не отличаются высокой точностью из-за отсутствия механизмов исправления ошибок; поэтому скорость накопления мутаций у вирусов с РНК-геномом выше, чем у ДНК-вирусов [13]. Из-за постепенных точечных изменений гемагглютинина и нейраминидазы возникают штаммы вируса, настолько отличающиеся от предыдущих вариантов, что наша иммунная система распознает их как совершенно новые. Именно поэтому эффективность вакцины против гриппа снижается с каждым последующим сезоном, и необходимо обновлять состав и вакцинировать всех заново.
Второй механизм, сдвиг антигена, гораздо более радикален. Это обмен вариантами гемагглютинина и нейраминидазы между разными вирусами при сборке вирусной частицы. В настоящее время для вируса гриппа А в природе обнаружено 18 подтипов гемагглютинина и 11 подтипов нейраминидазы, которые теоретически могут сочетаться в любых сочетаниях, многие из которых встречаются у животных [14]. В нашей популяции были обнаружены штаммы с сочетаниями H1N1 (гемагглютининовый подтип 1 и нейраминидаза подтип 1), H2N2 и H3N2. Но если два вируса с разными комбинациями заражают одну и ту же клетку, может произойти реассортация — перетасовка вариантов, в результате которой образуется вирус с новой комбинацией подтипов гемагглютинина и нейраминидазы. Именно антигенный сдвиг привел к возникновению самых смертоносных пандемий 20 века — «азиатского» (1-2 млн смертей) и «гонконгского» (0,5-2 млн смертей) гриппа [2], [15]. Не так давно, в 2009 г., мы столкнулись с новой пандемией, вызванной вирусом свиного гриппа со сложной историей перегруппировок, на долю которой пришлось до 575 000 смертей [15]. Новый штамм A(H1N1)pdm09 возник в результате сочетания двух вирусов свиного гриппа А, один из которых явился результатом тройной реассортации (рис. 8) [16].
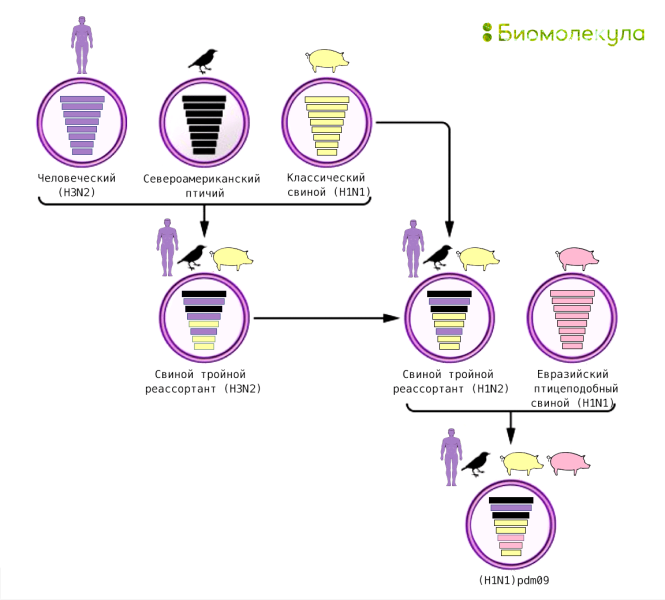
Рисунок 8. Появление нового штамма гриппа A(H1N1)pdm09 («свиной»), вызвавшего пандемию в 2009 г
иллюстрация Ирины Ефремовой по [16]
Вирус гриппа В намного скромнее. Несмотря на то, что для него возможны все те же механизмы изменчивости, что и для вируса гриппа А, серьезных эпидемий он не вызывает. Это связано с тем, что мы являемся практически единственными его переносчиками (кроме человека, вирус гриппа В был обнаружен только у тюленей [14]), а потому отсутствуют межвидовые рекомбинации, которые могли бы привести к возникновению принципиально новых штаммы. В настоящее время в нашей популяции в основном циркулируют штаммы двух линий вируса гриппа В: B/Victoria и B/Yamagata [8] [8].
Подробнее о поиске новых рекомбинаций и их последствиях можно прочитать в статье «Быстрая эволюция гриппа: как одни изменения приводят к другим» [17]. — Эд.
Видоспецифичность вируса гриппа
Вирус гриппа имеет огромный природный резервуар и поражает большое количество животных (рис. 9), но разные подтипы вируса поражают только определенные виды [14]. Это деление основано на взаимодействии между вирусным гемагглютинином и гликопротеинами на поверхности клетки-хозяина. Остаток сиаловой кислоты, с которым взаимодействует гемагглютинин, может быть присоединен к поверхностному белку через α-2,3 или α-2,6-связь, и в каждом случае будет иметь место различная пространственная ориентация остатка. Различные варианты гемагглютинина преимущественно связываются с тем или иным вариантом остатка .
Подробнее о структурных особенностях взаимодействия гемагглютинина с остатком сиаловой кислоты можно прочитать в статье «Объясняется различная вирулентность вирусов гриппа — возбудителей испанского гриппа» [18] (прим ред.
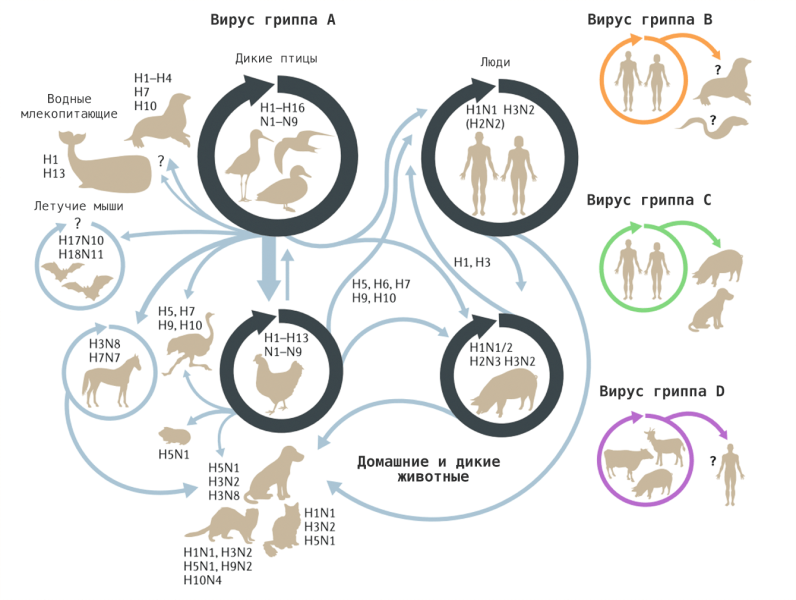
Рисунок 9. Видоспецифический диапазон различных типов вируса гриппа и межвидовая передача. Вирус гриппа А: гемагглютинины подтипов 1-16 циркулируют среди диких и домашних птиц и могут заражать другие виды напрямую или через промежуточных хозяев. Вирусы с подтипами гемагглютинина 17 и 18 обнаружены только в популяции летучих мышей. Среди адаптированных к человеку вирусов гриппа А известны вирусы с гемагглютининовыми подтипами 1, 2 и 3, но в настоящее время циркулируют только вирусы с комбинациями H1N1 и H3N2. Те же три подтипа гемагглютинина распространены у свиней. Вирусы птичьего гриппа А с подтипами гемагглютинина 5, 6, 7, 9 и 10 заразили людей после длительного контакта с птицами, но не приобрели способности передаваться от человека к человеку. Вирус гриппа В: циркулирует только среди людей, хотя случаи заражения были описаны у тюленей. Вирус гриппа С: циркулирует у людей и свиней. Вирус гриппа D: циркулирует в популяциях крупного рогатого скота, коз и свиней. Возможность заражения человека пока сомнительна.
[14]
В клетках верхних дыхательных путей человека чаще встречается α-2,6-сцепление, что определяет набор штаммов, циркулирующих в популяции человека. Но в нижних дыхательных путях есть и клетки со вторым вариантом связи — α-2,3, из-за этого мы иногда можем заразиться вирусом птичьего гриппа А H5N1, что приводит к тяжелой и быстропрогрессирующей пневмонии с летальным исходом выше 60 % [10].
Другими признаками, определяющими видовую специфичность, являются градиенты температуры и кислотности в дыхательных путях человека (рис. 10) [14].
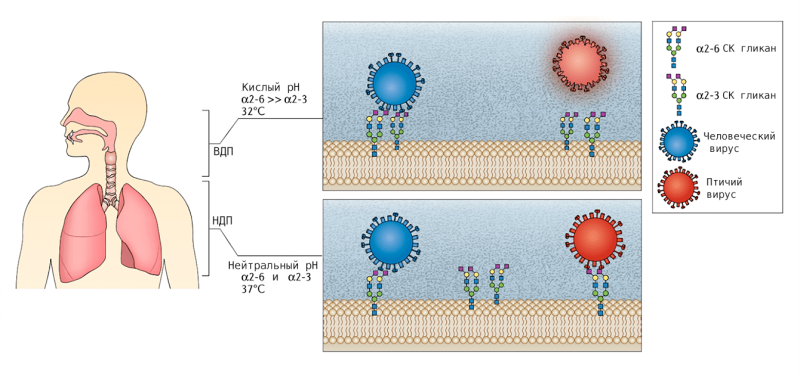
Рисунок 10. Характеристики дыхательных путей человека, влияющие на видовую специфичность вируса гриппа А В отличие от гемагглютинина вируса гриппа А человека гемагглютинин вируса птичьего гриппа А менее стабилен в кислой среде верхних дыхательных путей и может быть инактивирован. Верхние дыхательные пути человека также имеют более низкую температуру, при которой полимераза вируса гриппа А человека более активна, чем полимераза вируса птичьего гриппа А. Символы: ВДП, верхние дыхательные пути; БДС, нижние дыхательные пути; СА, сиаловая кислота.
[14]
Грипп или другая ОРВИ?
Симптомы гриппа знакомы практически каждому: внезапная лихорадка, кашель (чаще сухой), головная боль, боль в мышцах и суставах, слабость, боль в горле и насморк. При этом кашель может быть сильным и длиться две и более недель (обычно из-за повреждения эпителия дыхательных путей [19]). Но все это начинается не сразу, а только через 1-4 (в среднем 2) дня после заражения вирусом. Скрытая опасность гриппа заключается в том, что инфицированные становятся носителями еще до появления первых симптомов, т.е в инкубационный период. В первые 3-4 дня после появления симптомов больной наиболее заразен, поэтому важно оставаться дома при первых признаках болезни [20]! Описанные выше симптомы практически не отличаются от других ОРВИ, вызываемых еще двумя сотнями вирусов, и определить, имеем ли мы дело с гриппом или нет, можно только по результатам лабораторной диагностики [21].
Уже через 5-7 дней после начала заболевания большинство людей выздоравливают самостоятельно и уже не представляют опасности для окружающих, но у лиц, входящих в группу риска по гриппу, могут развиться серьезные опасные для жизни осложнения. Наиболее уязвимыми являются пожилые люди старше 65 лет, дети до 5 лет, беременные женщины и лица всех возрастов с хроническими заболеваниями практически всех систем органов или с подавленным иммунитетом. Осложнения могут быть как умеренными (синуситы, отиты), так и очень тяжелыми (пневмония, как вирусная, так и бактериальная). Кроме того, на фоне гриппа может возникнуть воспаление тканей сердца, головного мозга или мышц, а также полиорганная недостаточность. В ответ на вирусную инфекцию во всем организме может развиться неадекватно сильная воспалительная реакция (сепсис). Грипп также может ухудшить течение уже существующих хронических заболеваний [22].
К сожалению, из-за того, что вирус гриппа довольно быстро мутирует, у нас до сих пор нет эффективных противогриппозных препаратов. Почти 100% штаммов вируса гриппа A H3N2 и более 95% штаммов вируса гриппа A H1N1 уже устойчивы к обнаруженным когда-то блокаторам М2-каналов на основе адамантана (амантадину и римантадину), которые закупоривают канал как пробку [23]. Разработанные позже ингибиторы нейраминидазы (осельтамивир, занамивир, перамивир, ланинамивир), препятствующие завершению выхода вируса гриппа из клетки, часто приносят организму больше вреда, чем пользы, поэтому их следует применять с особой осторожностью [24]. Другие препараты находятся на различных стадиях клинических испытаний. Препарат балоксавир марбоксил, нацеленный на вирусную полимеразу, получил разрешение на применение в Японии и США только в 2018 г., но уже успел привести к появлению устойчивых к нему штаммов [25]. Методы лечения с использованием донорской плазмы или моноклональных антител, специфичных к низковариабельной (консервативной) области ГА, также проходят клинические испытания [26].
Кстати, вскоре были обнаружены устойчивые мутанты к ингибиторам нейраминидазы, о чем подробнее можно прочитать в статье «Костыль для нейраминидазы» [27]. — Эд.
Недавно нам удалось запомнить, какие существуют немедикаментозные способы защиты от распространения респираторных заболеваний, к которым относится как грипп, так и наш «новый друг» COVID-19. Во избежание заражения контактным путем необходимо регулярно мыть руки с мылом и не прикасаться грязными руками к слизистым оболочкам (рот, нос, глаза). Вы также можете снизить риск заражения, избегая тесного контакта с больными людьми, которые, в свою очередь, должны прикрывать рот и нос, когда кашляют и чихают, и оставаться дома, если они плохо себя чувствуют.
Грипп и COVID-19
Коронавирус SARS-CoV-2 является одним из тех вирусов, которые вызывают гриппоподобные симптомы, и до сих пор ведутся споры о серьезности новой коронавирусной инфекции по сравнению с гриппом. Грипп и COVID-19 имеют схожие клинические проявления и пути передачи, но есть и много различий. Грипп распространяется быстрее, чем COVID-19, и в основном через детей, в то время как взрослые чаще заражают детей новым коронавирусом. При ковид-19 доля тяжелых заболеваний выше, чем при гриппе, но серьезные осложнения чаще поражают пожилых людей и людей с хроническими заболеваниями, при этом грипп также представляет повышенный риск для детей и беременных женщин. Также, по предварительным оценкам, смертность от COVID-19 намного выше, чем от гриппа, особенно сезонно. И, что, пожалуй, самое главное, у нас уже несколько десятилетий есть вакцина против гриппа, что делает его, по крайней мере, контролируемой инфекцией — в отличие от COVID-19. Кстати, у Биомолекулы есть целая подборка статей о новом коронавирусе.
Зимой и летом разным цветом
Может показаться, что вирус гриппа каждый год куда-то пропадает на несколько теплых месяцев. Однако это заблуждение: вирус циркулирует среди нашего населения круглый год, а сезонные эпидемии случаются у жителей обоих полушарий земного шара, проживающих за пределами экваториальной зоны, в холодное или дождливое время года. Пока нельзя однозначно сказать, с чем это связано. Наиболее распространенное объяснение состоит в том, что в этот период года мы проводим больше времени в помещении и в компании друг друга, кашляя, чихая, разговаривая и просто дыша одним и тем же воздухом [28]. Особенно это проявляется в школах и детских садах, так как дети наиболее активно болеют гриппом и распространяют инфекцию. Кроме того, вирус гриппа более эффективно распространяется и лучше выживает при более низких температурах и меньшей абсолютной влажности, что характерно для зимы [29], [30]. Наконец, существует гипотеза, связывающая восприимчивость к респираторным заболеваниям в зимнее время года с ослаблением иммунитета в результате дефицита витамина D, возникающего из-за недостатка солнечного света [31]. Однако витамин D содержится в некоторых продуктах питания и является жирорастворимым, поэтому он хорошо усваивается в кишечнике и может запасаться в жировой ткани и других тканях нашего организма на несколько месяцев вперед [32].
Спасительный укол?
Зачем нам вакцинация от гриппа
Эпидемии серьезно нагружают систему здравоохранения и могут привести к нехватке больничных коек, что критично для людей, страдающих тяжелыми осложнениями гриппа. Однако в то же время было показано, что вакцинация может облегчить эту проблему и предотвратить тысячи смертей и десятки тысяч госпитализаций [33]. В большом метаанализе исследователи рассмотрели 17 рандомизированных контролируемых испытаний и 14 обсервационных исследований, опубликованных в период с 1967 по 2011 год, и определили среднюю эффективность вакцин против гриппа. Эффективность вакцинации варьировала от сезона к сезону, но в среднем составляла 59% для трехвалентной инактивированной вакцины у взрослых в возрасте 18–65 лет и 83% для живой аттенуированной вакцины у детей в возрасте от 6 месяцев до 7 лет [34].
Кроме того, хотя и косвенно, широкая вакцинация может защитить от гриппа людей, которые по состоянию здоровья не могут быть вакцинированы и остаются уязвимыми. Эти люди будут защищены коллективным иммунитетом, который сформируется, если будет вакцинировано большинство населения, что в дальнейшем предотвратит распространение вируса от человека к человеку. Однако, поскольку эффективность противогриппозной вакцины меняется от сезона к сезону, очень сложно рассчитать, какую долю людей необходимо вакцинировать для формирования необходимого уровня коллективного иммунитета (видео 2). По данным некоторых исследователей, каждый сезон в среднем необходимо вакцинировать около 80 % здорового населения и 90 % групп риска — показатели, весьма далекие от современного уровня охвата вакцинацией населения Российской Федерации. (~50%) [35], [36].
О том, что такое коллективный иммунитет, читайте в статье «Вакцинация перед школой: руководство для родителей» [37] — Ред.
Видео 2. Значение количества привитых для формирования коллективного иммунитета. В зависимости от доли вакцинированного населения (указана в процентах, отмечена желтыми точками) инфекция распространяется с разной скоростью (красные линии) в популяции, заражая людей без иммунной защиты (синие точки). Чем выше доля привитых, тем медленнее распространение возбудителя, но только при высоких значениях можно полностью заблокировать эпидемию и обеспечить защиту людей из групп риска.
Кстати, отсутствие симптомов не означает отсутствия инфекции, которая даже в этом случае может нанести вред организму. Оказывается, большинство людей заболевают гриппом бессимптомно. К такому выводу пришли британские исследователи, которые тестировали добровольцев и наблюдали за их здоровьем в течение нескольких сезонов [38].
Еще одним важным аспектом вакцинации является финансовый. Исследователи подсчитали, что издержки государства от повсеместной вакцинации намного меньше, чем потери, вызванные ежегодной эпидемией из-за сокращения рабочего времени, посещений врачей, покупки лекарств и оплаты больничных [39], [40]. Поэтому многие страны стремятся с каждым годом увеличивать охват вакцинацией населения, и наша страна не является исключением (рис. 11) [41].
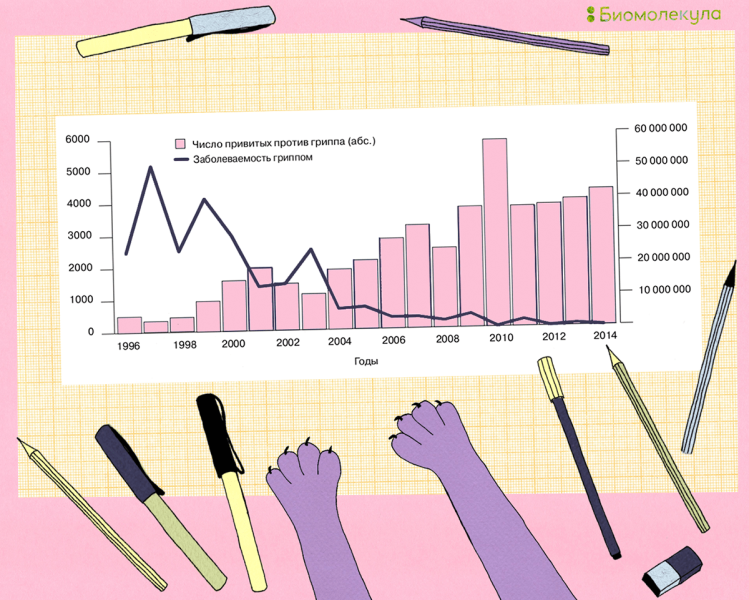
Рис. 11. Заболеваемость гриппом (правая ордината) и охват вакцинацией против гриппа (левая ордината) всего населения Российской Федерации в 1996–2014 гг. График показывает, насколько хорошо коррелирует рост числа вакцинированных со снижением числа случаев заболевания гриппом.
иллюстрация Ирины Ефремовой по [41]
Какие бывают вакцины?
Из всех одобренных вакцин рынок противогриппозной вакцины, пожалуй, самый разнообразный. Многие из них уже описаны в статье «Много не значит хорошо: Ультрикс», «Гриппол», «Совигрипп» — что выбрать? [42]. Однако давайте кратко рассмотрим, какие существуют типы вакцин, как они производятся и чем они отличаются.
Наличие широкого спектра противогриппозных вакцин обусловлено прежде всего тем, что в мире одновременно циркулируют разные штаммы вирусов гриппа А и В, а то и несколько одновременно в одной географической зоне. Поэтому противогриппозные вакцины многокомпонентные: трех- или четырехвалентные, то есть содержат три-четыре штамма (два штамма вируса гриппа А и один-два штамма вируса гриппа В). Производители из разных стран включают в свои вакцины разные штаммы в соответствии с ежегодными рекомендациями ВОЗ с 1973 г. [6].
С миру по нитке
Штаммы вируса гриппа для предстоящего сезона отбираются на основе тщательного анализа эпидемиологических данных и характеристик циркулирующих штаммов. Эпиднадзор осуществляется в течение всего года и по всему миру, что возможно только благодаря объединенным усилиям многих стран и организаций в рамках глобальной программы ВОЗ по гриппу. Эта система называется GISRS (Глобальная система эпиднадзора за гриппом и реагирования, GISRS). В его состав входят 114 стран, в которых расположены 144 национальных центра по гриппу (обозначенных для эпиднадзора и эпиднадзора первой линии), 6 международных центров передового опыта по гриппу, 4 основных контрольных лаборатории ВОЗ (участвующих в эпиднадзоре за гриппом и разработке вакцин) и 13 референс-лабораторий ВОЗ (для помочь странам и ВОЗ в раннем обнаружении и подтверждении новых вирусов животных). Все собранные данные передаются в общедоступную и еженедельно обновляемую базу данных FluNet. Результаты представлены в виде графиков и таблиц и могут быть проанализированы любым пользователем (рис. 12).
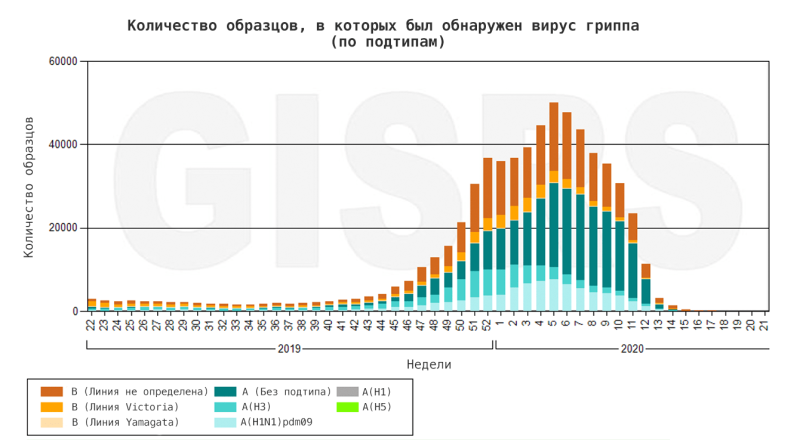
Рисунок 12. Количество образцов гриппа, собранных в северном полушарии в 2019–2020 гг
ЧЬЯ
Неудивительно, что такая налаженная сеть лабораторий и исследовательских центров пригодилась, когда мир столкнулся с новой пандемией, вызванной SARS-CoV-2, и часть мощностей этой системы была перенаправлена на тестирование, мониторинг и оценку эпидемиологической ситуации и изучения COVID-19.
Эффективность противогриппозной вакцины во многом зависит от степени перекрытия между вакциной и циркулирующими штаммами, но даже в случае неудачного прогноза вакцина обеспечивает перекрестную защиту, которая хотя и менее эффективна, но обеспечивает защиту от вируса гриппа [43]. Следующим важным фактором, влияющим на эффективность вакцинации, является ее иммуногенность (способность вызывать иммунный ответ). Для достижения наилучшего результата используется ряд вакцинных технологий, а также различные вспомогательные вещества .
Адъювант — это вещество, которое вводят вместе с антигеном для усиления иммунного ответа на вакцину. Подробнее о том, как делаются вакцины, можно прочитать в статье «Разработка вакцин: как и как имитировать заболевание?» [7]. — Эд.
По типу противогриппозные вакцины делятся на живые ослабленные и инактивированные (рис. 13), представленные убитым вирусом (цельновирионные вакцины) или его частями (сплит-вакцины, они же расщепленные, а также субъединичные и виросомальные). Первая разработанная вакцина против гриппа была живой, но сейчас большинство вакцин против гриппа инактивированы. Каждый год список доступных вакцин может меняться, вы можете уточнить это у своего врача.
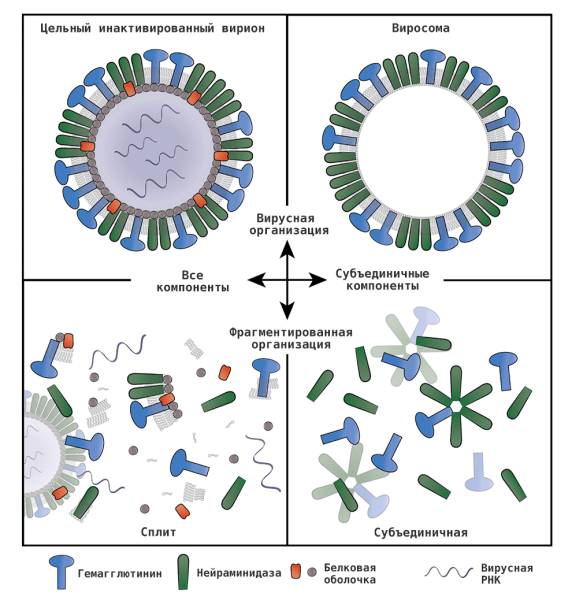
Рисунок 13. Альтернативы инактивированной противогриппозной вакцине
[48]
Различные типы вакцин имеют разные пути введения. Живые аттенуированные вакцины вводятся с помощью назального спрея, и таким образом вакцинный вирус гриппа проникает непосредственно в слизистую оболочку верхних дыхательных путей и имитирует естественную инфекцию, стимулируя как системный, так и местный иммунитет. Удивительно, но живые аттенуированные вакцины не могли конкурировать по эффективности с инактивированными вакцинами, хотя теоретически они должны были вызывать более сильный и всеобъемлющий иммунный ответ [44]. Возможно, проблема в том, что многие из нас неоднократно сталкивались с вирусом гриппа, а иммунитет наших слизистых оболочек уже хорошо натренирован и убивает вакцинный вирус слишком быстро, из-за чего системный иммунитет не успевает в нем полностью освоиться. Это предположение согласуется с тем, что живые аттенуированные вакцины у детей более эффективны, чем инактивированные [34], [45], и, несмотря на все трудности производства, некоторые страны рекомендуют выбирать именно этот тип вакцин для детей. В то же время для взрослых не обнаружено существенной разницы между живыми аттенуированными и инактивированными вакцинами, поэтому можно выбрать любую (если вы не входите в группу риска) [46].
Одним из обстоятельств, связанных с ограниченным использованием живых вакцин, является неконтролируемое накопление мутаций в геноме вакцинного вируса и его возможный возврат к патогенному варианту (это описано, например, для вакцины против вируса полиомиелита [47].). Но в отношении гриппа такие случаи на практике не регистрировались и маловероятны. Другая проблема заключается в том, что использование живой аттенуированной гриппозной вакцины иногда вызывает проблемы с дыханием у детей в возрасте до двух лет, поэтому ее применение ограничено в возрасте от 2 до 49 лет [48].
В случае с инактивированными вакцинами для стимуляции иммунного ответа и формирования надежной защиты требуется гораздо больше антигена, так как вирус не будет размножаться в организме привитого человека. Поэтому такие вакцины начали разрабатывать только после 1944 г., когда Уэнделл Стэнли подробно описал процедуру приготовления гриппозной вакцины, выращенной на куриных эмбрионах, а затем инактивированной различными методами и концентрированной и очищенной дифференциальным центрифугированием [6].
Инактивированные вакцины вводят внутримышечно или подкожно. Первая широко применявшаяся инактивированная гриппозная вакцина была цельновирионной и вызывала большое количество побочных эффектов, которые, вероятно, были связаны с недостаточной степенью очистки вакцины от фрагментов куриного яйца. Современные методы производства позволяют решить эту проблему. Позднее в практику были внедрены вакцины, содержащие только очищенные фрагменты вируса. Эти препараты вызывают меньше побочных эффектов, но содержат более ограниченный спектр антигенов вируса гриппа. Тем не менее мета-анализы показывают, что все исследованные зарегистрированные инактивированные вакцины обладают сходной иммуногенностью и безопасностью [48]. В ответ на них в сыворотке крови образуется хороший титр нейтрализующих антител, но они слабо стимулируют гуморальный ответ в слизистых оболочках и клеточный иммунитет [49].
Как производят вакцины против гриппа
В связи с тем, что вирус гриппа постоянно мутирует, процесс производства вакцин является результатом взвешенного решения сложной дилеммы: чем ближе к сезону, тем больше вероятность совпадения вакцинного и сезонного штаммов, но при этом времени, тем позднее время поступления вакцины в продажу, и, следовательно, возрастает риск не успеть к началу сезона. Производство каждой сезонной вакцины включает в себя отбор необходимых штаммов, создание вакцинного вируса, его производство, очистку, проверку на эффективность и безопасность и получение лицензии – только после прохождения всех этих этапов ее можно продавать. Но нам еще нужно успеть разработать вакцину в достаточном количестве для продажи! В дополнение к сезонным вакцинам, производимым каждый год, было разработано несколько вакцин против пандемических вирусов свиного и птичьего гриппа. Некоторые из них уже использовались во время предыдущих эпидемий, другие зарезервированы для будущих [48].
Кому и когда прививаться от гриппа в России
ежегодная вакцинация начинается с момента размещения препарата на рынке. Обычно это происходит уже в сентябре, а вакцина доступна в течение всего сезона. Согласно Национальному календарю прививок, прививаться можно в любом возрасте, начиная с шести месяцев. Если ребенок прививается впервые, необходимо провести двукратную вакцинацию с интервалом в четыре недели. Это связано с тем, что маленькие дети, скорее всего, еще не болели гриппом, и иммунизации будет недостаточно для формирования необходимого уровня защитных антител. Потом можно прививать раз в сезон.
По оценкам исследователей, дети в возрасте до 5 лет и пожилые люди старше 65 лет особенно уязвимы к гриппу, поэтому вакцинация чрезвычайно важна как для них, так и для людей, которые живут с ними и ухаживают за ними. В группу риска также входят беременные женщины, лица с хроническими заболеваниями (в том числе с заболеваниями легких, сердечно-сосудистыми заболеваниями, заболеваниями обмена веществ и ожирением) и взрослые лица некоторых профессий, имеющих повышенный риск заражения (работники медицинских и образовательных организаций, транспорта и коммунального хозяйства) услуги).
Как и многие национальные вакцины, вакцину против гриппа можно вводить в тот же день, что и другие вакцины (кроме туберкулеза), но в разные части тела и с помощью разных шприцев. В противном случае интервал между прививками должен быть не менее одного месяца. Имеются ограничения и для диагностики туберкулеза (пробы Манту): поскольку прививки могут влиять на чувствительность к вводимому туберкулину, вакцинацию проводят только после оценки результатов пробы Манту или за месяц до туберкулинодиагностики. Для вакцинации детей и беременных женщин разрешены только вакцины, не содержащие консервантов.
А можно ли при беременности?
Доказано, что беременные женщины болеют гриппом так же часто, как и небеременные женщины того же возраста, но имеют более высокий риск развития серьезных осложнений. Инфекция может повлиять как на здоровье будущей матери, так и на развитие плода. Помимо вышеперечисленных осложнений, грипп, протекающий в I триместре, может вызывать нарушения формирования нервной и сердечно-сосудистой систем ребенка, а на поздних сроках беременности гриппозная инфекция может спровоцировать преждевременные роды, вызвать недовес новорожденного или даже мертворождение [50].
Поскольку вирус гриппа редко проникает через плацентарный барьер, наиболее вероятно, что негативное воздействие на плод напрямую связано с воспалительными реакциями при инфицировании [50]. Кроме того, беременность сопровождается серьезными системными изменениями в работе самой иммунной системы: сложный баланс между провоспалительными и противовоспалительными процессами смещается в ту или иную сторону на разных сроках беременности, в связи с чем беременные более чувствительны к некоторым инфекциям [51].
По имеющимся данным, вероятность развития легких побочных эффектов после вакцинации против гриппа у беременных такая же, как и у остального взрослого населения. Также не было обнаружено связи между вакцинацией и повышенным риском невынашивания, мертворождения, преждевременных родов и появления врожденных пороков развития у плода [52]. А поскольку возможен перенос нейтрализующих антигриппозных антител через плаценту [53], ребенок от вакцинированной матери будет иметь защиту от вируса гриппа в течение первых нескольких наиболее уязвимых месяцев жизни [54]. Дополнительную защиту обеспечат специфичные к вирусу гриппа IgA-антитела, которые в большом количестве присутствуют в грудном молоке вакцинированной женщины [55].
И ВОЗ, и Минздрав РФ рекомендуют прививать беременных от гриппа, но вакцинацию лучше планировать до беременности или во втором и третьем триместре. Несмотря на высокую безопасность вакцины, данных о ее влиянии на формирование основных систем органов плода в I триместре беременности пока недостаточно [52]. По той же причине беременным женщинам противопоказаны живые гриппозные вакцины и вакцины, содержащие консерванты.
Противопоказания к вакцинации
Современные вакцины могут быть изготовлены с использованием как куриных эмбрионов, так и клеточных культур, поэтому даже люди с аллергией на белок куриного яйца теперь могут быть вакцинированы против гриппа. Однако следует соблюдать осторожность, так как в ответ на другие компоненты вакцины может развиться тяжелая аллергическая реакция. Кроме того, частые ОРВИ и хронические заболевания не являются поводом для отказа от вакцинации против гриппа. Вакцину вводят через 5-10 дней после выздоровления от очередного ОРВИ или в период ремиссии хронического заболевания, но этот вопрос всегда следует предварительно обсудить с лечащим врачом. Более подробную информацию о вакцинации детей и взрослых с различными нарушениями здоровья можно найти в методических указаниях МУ 3.3.1.1123-02 «Наблюдение за осложнениями после вакцинации и их профилактика».
Для некоторых противогриппозных вакцин (особенно живых аттенуированных) беременность и кормление грудью могут быть противопоказаниями. Поэтому перед прививкой обязательно проконсультируйтесь с врачом или прочтите инструкцию к вакцине. Многие инактивированные вакцины безопасны для беременных женщин и плода, а также для кормящих матерей и их детей.
Побочные реакции на вакцинацию
В большинстве случаев серьезных осложнений в ответ на вакцинацию против гриппа не возникает. Если была введена инактивированная вакцина, возможны побочные эффекты в месте инъекции в виде покраснения, отека и болезненности. После введения живой аттенуированной вакцины возможно появление легкого насморка и легкого кашля. Также возможны лихорадка, дискомфорт, тремор, потливость, болезненность в мышцах и суставах. И в любом случае в течение 30 минут после прививки необходимо оставаться под наблюдением врача, так как всегда существует вероятность аллергической реакции или развития других (более редких) осложнений.
Можно ли победить грипп?
К сожалению, нельзя сказать, что грипп находится под полным контролем. Вирус все время мутирует, и при несоответствии вакцинного и циркулирующего штаммов эффект вакцинации снижается. И самое главное, мы никогда не избавимся от возбудителя, потому что у него самый обширный природный резервуар, а у нас нет сил и средств вакцинировать всех животных в мире. Однако это не означает, что ситуация не может улучшиться.
Основываясь на 70-летнем опыте, ВОЗ разработала Глобальную стратегию по гриппу на 2019-2030 гг., которая включает разработку глобальных и национальных программ по снижению воздействия сезонного гриппа, минимизации риска проникновения зоонозного гриппа в человеческую популяцию и снижению воздействия пандемического гриппа. По данным ВОЗ, для достижения наших целей нам нужны более совершенные методы профилактики, выявления, контроля и лечения гриппа, включая более эффективные вакцины и противовирусные препараты. Разработка собственных программ и инвестиции в борьбу с гриппом помогут развить различные направления системы здравоохранения и сделать страну в целом более подготовленной к новой пандемии, которая может не только унести сотни тысяч жизней, но и вызвать социальное -экономический кризис. И, как мы уже знаем, его приход — лишь вопрос времени.
Например, недавно на свиноводческих фермах был обнаружен новый штамм G4 вируса гриппа A H1N1, который способен заражать людей, но существенно отличается от «человеческих» штаммов, то есть обладает пандемическим потенциалом. Но, к счастью, вирус был обнаружен в ходе масштабного скринингового исследования, а не в разгар очередной эпидемии, и у нас еще есть время подготовить варианты вакцины с этим штаммом «на всякий случай».
Высокие технологии также использовались для борьбы с гриппом. Вычислительная мощность современных компьютеров активно используется как при разработке новых вакцин [59], так и для прогнозирования новых штаммов, которые будут циркулировать в следующем сезоне (видео 3) [17].
Видео 3. Георгий Базыкин: «Как предсказать будущий эволюционный успех вируса?»
«Постнаука»
Универсальная вакцина
Еще одним недостатком современных противогриппозных вакцин, о котором не упоминалось выше, является возможность антигенного импринтинга. При столкновении нашего иммунитета с новым вариантом вируса гриппа (в результате заражения или вакцинации) предпочтительнее активировать иммунологическую память, сформировавшуюся в результате предыдущих контактов с тем же возбудителем и распознающую неизмененные фрагменты вируса вируса, подавляя таким образом образование антител против измененных (новых для иммунитета) участков [60]. Однако очень сложно проверить, действительно ли предшествующие вакцинации и инфекции влияют на эффективность последующих, так как эффективность вообще зависит от широкого круга различных факторов [61]. Поэтому есть данные, показывающие как наличие негативных последствий [61], так и их отсутствие [62].
Эту и многие из описанных выше проблем можно было бы решить, разработав одну универсальную вакцину, которой мы будем вакцинироваться один или несколько раз в течение жизни, как это делается в случае с вакцинами против других инфекций. Теоретически такая вакцина возможна, так как вирус гриппа, несмотря на активное накопление мутаций, всегда имеет консервативные участки, фатальное для него изменение. «Обучение» иммунитета распознаванию этих участков с последующим развитием иммунного ответа, достаточного для защиты, сделает организм устойчивым к любому из постоянно обновляющихся штаммов.
Попытки создать универсальную вакцину предпринимаются уже более десяти лет. Исследователи тестируют различные антигены-мишени, технологические платформы для их разработки и методы иммунизации. Наиболее успешные уже находятся на первой или второй фазе клинических испытаний [63], [64]. В целом их можно разделить на две группы в зависимости от того, на какую ветвь иммунитета нацелена вакцина: гуморальную (антитела, блокирующие вирус) или Т-клеточную (рис. 14). В первом случае наибольшей популярностью пользуются гемагглютининовый «стебель» (белковый фрагмент, расположенный ближе к вирусной мембране) и часть белка ионного канала М2, состоящего из 23 аминокислот (М2е). Для Т-клеток (которые убивают инфицированные клетки, чтобы остановить распространение вируса по организму) выбранными антигенами были нуклеопротеин и матриксный белок 1, которые активно синтезируются в инфицированной клетке и имеют решающее значение на многих этапах жизни вируса цикл. Существуют также вакцины на основе полимеразы вируса гриппа [65].
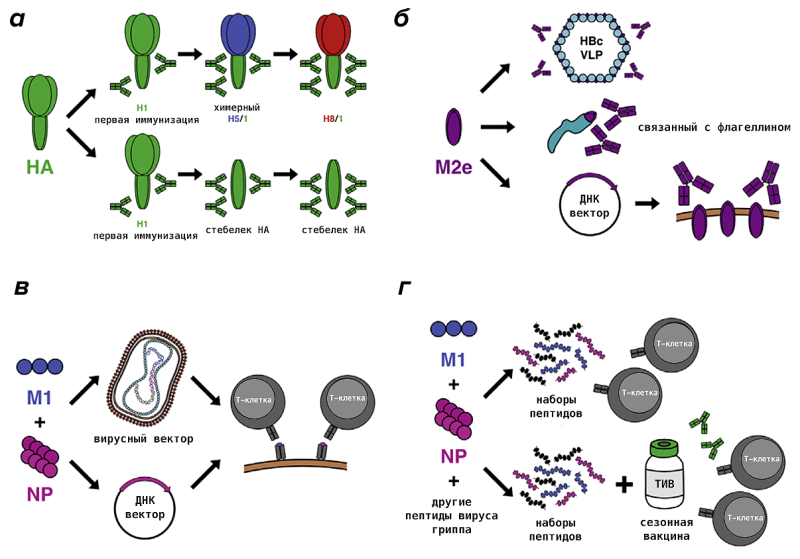
Рисунок 14. Разрабатываемые варианты универсальных гриппозных вакцин а — Использование химерных гемагглютининов (несколько последовательных вакцинаций гемагглютининами (ГА) с разными «головками», но одним и тем же «стержнем» будут способствовать формированию пула антител против «повторяющихся» антиген, что будет говорить идентичный «стебель»), либо вакцинация исключительно «стебельчатой» частью гемагглютинина b — Иммунизация консервативным фрагментом белка М2 (М2е), который ассоциирован с вирусоподобными частицами, состоящими из вируса гепатита В вирусный белок и липиды (HBc VLP) или с бактериальным белком флагеллином; или с помощью ДНК-вектора c — Матриксный белок 1 и нуклеопротеин могут быть доставлены в клетки нашего организма с помощью вирусного вектора (например, осповакцины) или ДНК-вектора (ДНК-вакцина) d — Пептидные вакцины, состоящие из фрагментов матриксного белка 1, нуклеопротеин и другие белки вируса гриппа, которые можно вводить отдельно или в сочетании с обычными вакцинами против сезонного гриппа (TIV — трехвалентная инактивированная вакцина) для обеспечения более комплексного иммунного ответа.
[64]
Каждый год мы слышим о важности вакцинации против гриппа, и у нас появляется все больше и больше возможностей сделать это. И стоит ли в очередной раз пренебрегать этим советом, если вакцина от гриппа безопасна и имеет доказанную эффективность? Надеемся, что в этой статье нам удалось доступно объяснить, почему вокруг вакцинации против гриппа во всем мире столько внимания и почему она может спасти жизнь вам и вашим близким.

«Национальная иммунобиологическая компания» — партнер статьи о гриппе
«Нацимбио» — фармацевтическая группа, созданная Госкорпорацией Ростех в 2013 году с целью развития производства иммунобиологических препаратов, важных для национальной безопасности. В структуру компании входят российские производственные компании ОАО «НПО «Микроген», ОАО «Синтез» и ООО «ФОРТ». Среди рыночных приоритетов «Нацимбио» — разработка, производство полного цикла и реализация вакцин и анатоксинов из действующих и перспективных национальных календарей прививок, препаратов крови, бактериофагов, аллергенов, аллергоидов и других препаратов. Стратегической целью предприятия является трансфер технологий и локализация производства иммунобиологических препаратов, производство которых отсутствует в России.
Материал предоставлен партнером — компанией «Нацимбио»
Литература
- Семенов А.В. Этимологический словарь русского языка. М.: Издательство «УНВЕС», 2003;
- JK TAUBENBERGER, DM MORENS. (2009). Пандемический грипп — включая оценку риска H5N1. Рифовая наука. Тех. МЭБ 28, 187-202;
- Найл ПАС Джонсон, Юрген Мюллер. (2002). Обновление счетов: Глобальная смертность от пандемии «испанского» гриппа 1918-1920 гг. Вестник истории медицины. 76, 105-115;
- Дж. К. Таубенбергер. (1997). Начальная генетическая характеристика вируса «испанского» гриппа 1918 г. Наука. 275, 1793-1796;
- Угроза пандемического гриппа — издательство национальных академий, 2005 г;
- Клод Ханнун. (2013). Развитие истории вирусов гриппа и вакцин против гриппа. Экспертиза вакцин. 12, 1085-1094;
- Разработка вакцины: как и как имитировать болезнь?;
- Велислава Н. Петрова, Колин А. Рассел. (2018). Эволюция вирусов сезонного гриппа. Nat Rev Microbiol. 16, 47-60;
- Шуо Су, Синьлян Фу, Гайру Ли, Фиона Керлин, Майкл Вейт. (2017). Новый вирус гриппа D: эпидемиология, патология, эволюция и биологические свойства вирулентности. 8, 1580-1591;
- Николь М. Бувье, Питер Палезе. (2008). Биология вирусов гриппа вакцина. 26, Д49-Д53;
- Тимо Френсинг, Саша Ю. Купке, Мэнди Бахманн, Сюзанна Фритцше, Лили Э. Галло-Рамирес, Удо Райхл. (2016). Динамика внутриклеточной репликации вируса гриппа, кинетика высвобождения и морфология частиц при размножении в клетках MDCK. Приложение Microbiol Biotechnol. 100, 7181-7192;
- Александр Пфлуг, Мария Лукарска, Патрисия Реза-Инфанте, Стефан Райх, Стивен Кьюсак. (2017). Структурное понимание синтеза РНК механизма репликации транскрипции вируса гриппа Virus Research. 234, 103-117;
- Кён Х. Чой. (2012). Вирусные полимеразы. Вирусные молекулярные машины. 267-304;
- Джейсон С. Лонг, Бхакти Мистри, Стюарт М. Хаслам, Венди С. Барклай. (2019). Хозяин и вирусные детерминанты специфичности вируса гриппа А. Nat Rev Microbiol. 17, 67-81;
- Патрик Сондерс-Гастингс и Даниэль Кревски. (2016). Обзор истории пандемического гриппа: понимание закономерностей появления и передачи патогенов. 5, 66;
- Донна М. Черне, Адольфо Гарсия-Састре. (2011). Детерминанты вирулентности вирусов пандемического гриппа. Дж. Клин. Инвест.. 121, 6-13;
- Темы: «Быстрая эволюция гриппа: как одно изменение ведет к другому»;
- Объяснил различную вирулентность вирусов гриппа — причины «испанки»;
- Овчинников А.Ю., Край М.А., Коростелев С.А., Митюк А.М. (2015). Постинфекционный кашель: основные заблуждения и возможности современной терапии. «Медицина». 1, 76–83;
- Линда Дж. Кейлман. (2019). Сезонный грипп (грипп). Сестринские клиники в Северной Америке. 54, 227-243;
- Витторио Демичели, Том Джефферсон, Элиана Феррони, Алессандро Риветти, Карло Ди Пьетрантонж. (2018). Вакцины для профилактики гриппа у здоровых взрослых. Кокрановская база данных систематических обзоров;
- Линда Дж. Кейлман. (2019). Сезонный грипп (грипп). Сестринские клиники в Северной Америке. 54, 227-243;
- Хань Джу, Цзянь Чжан, Боши Хуанг, Дунвэй Канг, Бин Хуанг и др. (2017). Ингибиторы полимеразной кислой (ПК) эндонуклеазы вируса гриппа: современные разработки и перспективы. Дж. Мед хим. 60, 3533-3551;
- Том Джефферсон, Марк А. Джонс, Питер Доши, Крис Б. Дель Мар, Рокуро Хама и др. (2014) Ингибиторы нейраминидазы для профилактики и лечения гриппа у взрослых и детей;
- Лосева П. (2019). Противовирусный препарат сделал вирус гриппа более устойчивым. Н+1;
- Флориан Краммер, Гэвин Дж. Д. Смит, Рон А. М. Фушье, Малик Пейрис, Кэтрин Кедзерска и др. (2018). Грипп. Nat Rev Dis Primer. 4;
- «костыль» для нейраминидазы;
- Русакова Е. (2018). Дыхания пациентов было достаточно, чтобы распространить грипп. Н+1;
- Энис Си Лоуэн, Самира Мубарека, Джон Стил, Питер Палезе. (2007). Передача вируса гриппа зависит от относительной влажности и температуры. PLoS Патог. 3, е151;
- Дж. Шаман, М. Кон. (2009). Абсолютная влажность влияет на выживаемость, передачу и сезонность гриппа. Труды Национальной академии наук. 106, 3243-3248;
- JJ CANNELL, R. VIETH, JC UMHAU, MF HOLICK, WB GRANT и др. (2006). Эпидемия гриппа и витамин D. Эпидемиол. Infect.. 134, 1129-1140;
- Иева Мартинайтете, Елена Камычева, Аллан Дидриксен, Йетте Якобсен, Рольф Йорде. (2017). Витамин D, накопленный в жировой ткани в течение 5-летнего вмешательства, влияет на уровень 25-гидроксивитамина D в сыворотке крови в следующем году. Журнал клинической эндокринологии и метаболизма. 102, 3731-3738;
- Мелисса А. Рольфес, Иво М. Фоппа, Шикха Гарг, Брендан Фланнери, Линнетт Браммер и др. (2018). Ежегодные оценки бремени сезонного гриппа в Соединенных Штатах: инструмент для усиления эпиднадзора за гриппом и обеспечения готовности. Грипп Другие вирусы Респи. 12, 132-137;
- Майкл Т. Остерхольм, Николас С. Келли, Альфред Соммер, Эдвард А. Белонгиа. (2012). Эффективность и действенность вакцин против гриппа: систематический обзор и метаанализ. Ланцет Инфекционные заболевания. 12, 36-44;
- Педро Планс-Рубио. (2012). Охват вакцинацией необходим для создания коллективного иммунитета против профилактической медицины против вируса гриппа. 55, 72-77;
- Роспотребнадзор достиг максимального уровня охвата вакцинацией против гриппа. (2020). ТАСС;
- Прививка перед школой: руководство для родителей;
- Эндрю С. Хейворд, Эллен Б. Фрагаси, Элисон Бермингем, Лили Ванг, Эндрю Копас и др. (2014). Сравнительное социальное бремя и тяжесть сезонного и пандемического гриппа: результаты когортного исследования Flu Watch. Ланцет Респираторная медицина. 2, 445-454;
- Кэролин Бакстон Бриджес, Уильям В. Томпсон, Мартин И. Мельцер, Гордон Р. Рив, Уолтер Дж. Таламонти и др. (2000). Эффективность и рентабельность вакцинации против гриппа здоровых работающих взрослых. ДЖАМА. 284, 1655;
- Глобальная стратегия борьбы с гриппом на 2019–2030 гг. Женева: Всемирная организация здравоохранения, 2019 г;
- Попова А.Ю., Ежлова Е.Б., Мельникова А.А., Фролова Н.В., Михеев В.Н., Рыжиков А.Б и др. (2016). Влияние ежегодной иммунизации населения против гриппа на заболеваемость этой инфекцией в Российской Федерации. «Эпидемиология и вакцинопрофилактика». 15, 48–55;
- Много не значит хорошо: Ультрикс, Гриппол, Совигрипп — что выбрать?;
- Андреа С. Трикко, Айман Чит, Шарлин Субиа, Дэвид Халлетт, Женевьев Мейер и др. (2013). Сравнение эффективности противогриппозной вакцины против несовпадающих и совпадающих штаммов: систематический обзор и метаанализ. BMC С одиннадцатью;
- Майкл Шотсарт, Адольфо Гарсия-Састре. (2017). Инактивированные вакцины против вируса гриппа: будущее TIV и QIV. Современное мнение в вирусологии. 23, 102-106;
- Джанель Рорер, Кристофер С. Амброуз, Стефани Дикинсон, Холли Гамильтон, Наполеон А. Олека и др. (2009). Эффективность живой ослабленной вакцины против гриппа у детей: метаанализ девяти рандомизированных клинических испытаний вакцина. 27, 1101-1110;
- WEP Beyer, AM Palache, JC de Jong, ADME Osterhaus. (2002). Холодоадаптированная живая гриппозная вакцина в сравнении с инактивированной вакциной: системные реакции на вакцину, местные и системные реакции антител и эффективность вакцины вакцина. 20, 1340-1353;
- Полиомиелит: убийца 20 века;
- Питер С. Соэма, Рональд Компьер, Жан-Пьер Аморий, Гидеон Ф. А. Керстен. (2015). Вакцины против гриппа текущего и нового поколения: рецептуры и стратегии производства. Европейский журнал фармацевтики и биофармацевтики. 94, 251-263;
- Р. Дж. Кокс, К. А. Брокстад, П. Огра. (2004). Вирус гриппа: иммунитет и стратегии вакцинации. Сравнение иммунного ответа на инактивированные и живые аттенуированные гриппозные вакцины. Сканд Дж. Иммунол. 59, 1-15;
- Саад Б. Омер, Роберт Беднарчик, Шабир А. Мадхи, Кейт П. Клагман. (2012). Преимущества для матери и ребенка вакцины против гриппа во время беременности. Вакцины и иммунотерапия для человека. 8, 130-137;
- Гил Мор, Ингрид Карденас. (2010). Иммунная система во время беременности: уникальная сложность. Американский журнал репродуктивной иммунологии. 63, 425-433;
- Поль Лубе, Солен Кернеис, Оливия Анселем, Василис Цацарис, Франсуа Гоффине, Одиль Лоне. (2014). Нужно ли будущим мамам прививаться от гриппа? Обзор безопасности. Мнение экспертов о безопасности лекарств. 13, 1709-1720;
- Лиза А. Джексон, Шитал М. Патель, Гита К. Свами, Шэрон Э. Фрей, К. Бадди Крич и др. (2011). Иммуногенность инактивированной моновалентной вакцины против гриппа H1N1 2009 у беременных женщин. Журнал инфекционных заболеваний. 204, 854-863;
- К. Заман, Элиза Рой, Шамс Э. Арифин, Махбубур Рахман, Рубхана Ракиб и др. (2008). Эффективность иммунизации против гриппа у матерей и новорожденных. N Engl J Med. 359, 1555-1564;
- Элизабет П. Шлаудекер, Марк С. Стейнхофф, Саад Б. Омер, Моника М. МакНил, Элиза Рой и др. (2013). IgA и нейтрализующие антитела к вирусу гриппа А в грудном молоке: рандомизированное исследование антенатальной иммунизации против гриппа. ПЛЮС ОДИН. 8, е70867;
- Кеннет А. Маклин, Шошанна Голдин, Клаудия Нанней, Эрин Воробей, Гвидо Торелли. (2016). Глобальные производственные мощности по производству вакцины против сезонного и пандемического гриппа в 2015 г вакцина. 34, 5410-5413;
- Эвансон З. Самбала, Нтомбенхле Нгкобо, Шингай Мачингаидзе, Элисон Б. Вийе, Фетоле В. Махаша и др. (2019). Глобальный обзор внедрения вакцины против сезонного гриппа: анализ формы совместной отчетности ВОЗ/ЮНИСЕФ. Экспертиза вакцин. 18, 859-865;
- Катлинский А. (2020). Россия не может стоять в очереди за вакцинами. «Специалисты по вакцинации»;
- Масиге С. (2019). Австралийские исследователи только что выпустили первую в мире вакцину, разработанную искусственным интеллектом, и она может предотвратить новый ужасный сезон гриппа. «Бизнес инсайдер Австралия;
- Кэрол Генри, Анна-Карин Э. Палм, Флориан Краммер, Патрик С. Уилсон. (2018). От первородного антигенного греха к универсальной вакцине против вируса гриппа. Тенденции в иммунологии. 39, 70-79;
- Эдвард А. Белонгиа, Данута М. Сковронски, Хуонг К. Маклин, Кэтрин Чемберс, Мария Э. Сундарам, Гастон Де Серрес. (2017). Повторная ежегодная вакцинация против гриппа и эффективность вакцины: обзор доказательств. Экспертиза вакцин. 16, 723-736;
- Хуонг К. Маклин, Эрве Каспар, Мари Р. Гриффин, Манджуша Гаглани, Тимоти Р. Петерс и др. (2018). Связь предшествующей вакцинации с эффективностью вакцины против гриппа у детей, получающих живую аттенуированную или инактивированную вакцину. Сеть JAMA открыта. 1, е183742;
- Джузеппе А. Саутто, Грег А. Кирхенбаум, Тед М. Росс. (2018). На пути к универсальной вакцине против гриппа: разные подходы к одной цели. Вирол Дж. 15;
- Р. Нахбагауэр, Ф. Краммер. (2017). Универсальные противогриппозные вакцины и терапевтические антитела. Клиническая микробиология и инфекции. 23, 222-228;
- Венлинг Ван, Жэньцин Ли, Яо Дэн, Нин Лу, Хун Чен и др. (2015). Защитный эффект консервативных белков NP, PB1 и M1 как иммуногенов в универсальных вакцинах против гриппа А на основе ДНК и вируса осповакцины у мышей клин. Vaccine Immunol., 22, 618-630;
- Деклан Батлер. (2018). Призрак прошлого гриппа и поиск универсальной вакцины. Природа. 560, 158-160;
- Артьян Дж.В те Велтуис, Эрвин Фодор. (2016). РНК-полимераза вируса гриппа: понимание механизмов синтеза вирусной РНК. Nat Rev Microbiol. 14, 479-493.
[Источник]








 (8 оценок, среднее: 3,50 из 5)
(8 оценок, среднее: 3,50 из 5)
